Некоторые газы называются инертными и не реагируют на воздействие иных химических веществ. Из них нельзя синтезировать какое-то химическое соединение. Тем не менее, такие газы используют в промышленности, где актуальны их физические свойства. Один из инертных газов — аргон. В этой статье мы расскажем о характеристиках газа аргона, областях применения. Поясним, что это такое — газ аргон в химии и физике. Расскажем, какое давление в баллоне аргона поддерживается. Эта информация поможет вам лучше понять, в каких целях, каким образом с какими ограничениями вы можете использовать этот технический газ на вашем предприятии или в быту.
Способы получения аргона
В значительном объеме газ содержится в воздухе. Поэтому его выделяют из воздушной массы с помощью низкотемпературных ректификационных установок. Этот процесс протекает в несколько этапов:
- Воздух очищают от пылевых частиц, сжимают до получения жидкости.
- В жидком виде воздух из азота, кислорода, аргона ректифицируют.
- Отделив азот, смесь кислорода и аргона подвергают очистке, используя электролитический водород.
В ректификационной установке инертный газ кипит при −185,3˚С, кислород — на три градуса выше, азот — на тринадцать ниже.
Аргон также получают в процессах производства как побочный продукт. Его извлекают, производя аммиак. В данном случае Ar смешан с азотом и не представляет ценности, стоит намного дешевле криогенного аргона.
Химический элемент Ar
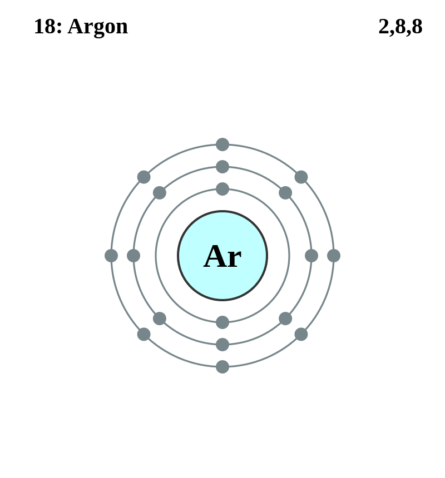
Ar – 18-й элемент периодической таблицы Менделеева, относящийся к благородным инертным газам. Данное вещество является третьим после N (азота) и O (кислорода) по содержанию в атмосфере Земли. В обычных условиях – бесцветен, не горюч, не ядовит, без вкуса и запаха.
Другие свойства газа аргона:
- атомная масса: 39,95;
- содержание в воздухе: 0,9% объема и 1,3% массы;
- плотность в нормальных условиях: 1,78 кг/м³;
- температура кипения: -186°С.

На рисунке название химического элемента и его свойства
Данный элемент был открыт Джоном Стреттом и Уильямом Рамзаем при исследовании состава воздуха. Несовпадение плотности при различных химических испытаниях натолкнуло ученых на мысль, что в атмосфере помимо азота и кислорода присутствует инертный тяжелый газ. В итоге в 1894 г. было сделано заявление об открытии химического элемента, доля которого в каждом кубометре воздуха составляет 15 г.
Виды аргона
Обнаружены изотопы аргона с атомной массой от 29 до 54. В воздухе 3 вида изотопов Ar:
- 40 (коэффициент распространения 99,600 %);
- 36 (коэффициент распространения 0,337 %);
- 38 (коэффициент распространения 0,063 %).
Агрегатных состояний три:
- жидкость — хранится в специальных емкостях и в дальнейшем газифицируется;
- газ;
- твердое тело.

Изотопы:
Три изотопа аргона существуют в природе. Эти изотопы — аргон-36, аргон-38 и аргон-40. Изотопы образуют два или более элемента. Изотопы различаются друг от друга в зависимости от их массового числа. Справа от названия элемента написано массовое число — это массовое число. Массовое число представлено количеством протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждое изменение — это изотопный элемент.
Радиоактивный изотоп — это тот, который распадается и испускает некоторую форму излучения. Радиоактивные изотопы образуются, когда маленькие частицы стреляют по атомам. Эти частицы застревают в атомах и делают их радиоактивным элементом.
Никакие радиоактивные изотопы аргона не имеют практического применения. Однако для определения возраста очень старых горных пород можно использовать один нерадиоактивный изотоп. Этот метод датировки и определения возраста пород описан в калийной записи.
Применение аргона
Где используется аргон? В промышленности много сфер его применения. Например, в химических реакциях для вытеснения из вещества кислорода. Эксплуатация аргона обходится дешевле в сравнении с иными инертными газами. Он формирует защитную среду при сварке метизов, вытесняет воду и кислород в резервуарах для хранения продуктов.
Аргоном наполняют колбы осветительных приборов — ламп накаливания. С ним приборы дольше и ярче светят. Применяют аргон и при изготовлении люминесцентных ламп. С ним легче зажигается электродуга, дольше служат электроды.
Аргоном заполняют стеклопакеты для окон, чтобы повысить их звуко- и теплоизоляцию. Газ прозрачен и позволяет оконным компаниям выпускать многослойные стеклопакеты с аргоном без ущерба для их светопрозрачности.
Применяют инертный газ и при плазменной резке металлоизделий. С ним дуга возникает при небольшом напряжении, можно использовать конструктивно простые аппараты. Когда с применением аргона генерируется плазма, получают минимум вредных летучих соединений при обработке металла. Вот почему для ручных аппаратов аргон — лучший компаньон.
Аргон применяют и в медицине. С его помощью выполняют аргоновую коагуляцию, удаляют новообразования, останавливают кровотечения.
В химической промышленности с использованием аргона получают сверхчистые вещества, анализируют их. В металлургии с помощью Ar перемешивают расплавленные вещества, обрабатывают тантал, титан, цирконий, бериллий и иные металлы. Инертный газ помогает сокращать окисление хрома при выпуске покрытой хромом стали.
Рекомендуем к прочтению:
- Сколько аргона расходуется при сварке?
- Какие сорта технического аргона бывают и для чего используются
История открытия
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею своё сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжёлого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном.
Применение аргона в сварке
Сваривая металлы, аргон используют для поддержания защитной среды. В случае работы с черными металлами, аргон смешивают с кислородом, двуокисью углерода, гелием, водородом.
Поскольку инертный газ тяжелее воздуха, он эффективнее защищает металлоизделия при сварочных работах. Распространяясь по поверхности метиза, аргон долго и надежно защищает обширный участок расплавленного и подогретого металла. В сварочных работах благодаря использованию аргона получают безупречный шов и повышают производительность. Шов хорошо проплавляется при одной проходке. С Ar можно применять более дешевые сварочные проволоки.
Сваривая алюминий в листах, аргон смешивают с гелием для оптимальной температуры обработки. При TIG сварке газ защищает сварочную ванну и оконечник электрода.

Используется:
- Благородный газ Аргон используется в ситуациях, когда материалы должны быть защищены от кислорода или других газов. Хорошим примером является лампа накаливания, состоящая из металлического провода внутри прозрачной стеклянной колбы. Электрический ток должен проходить через провод, что приводит к его сильному нагреву и испусканию света.
- Кислород очень легко соединяется с горячим металлом; в этой реакции образуется соединение металла и кислорода. Это соединение не очень хорошо проводит электрический ток, поэтому лампочка может перестать светиться.
- Тем не менее, для предотвращения этого используется аргон. Поскольку аргон инертен, он не вступает в реакцию с горячей проволокой, в результате чего металл остается горячим на долгое время. Лампочка перестанет светить только тогда, когда металл сломается. Тогда он больше не сможет проводить электрический ток.
- Аргон также можно использовать при сварке. Сварка — это процесс, при котором два металла соединяются друг с другом. В большинстве случаев оба металла нагреваются до очень высоких температур. По мере того, как они становятся все горячее и горячее, они тают вместе.
- Однако по мере того, как металл нагревается, они начинают реагировать с кислородом. В этой реакции образуется составной компонент металла и кислорода. Становится трудным объединить эти два металла, если они образовали соединения, но введение аргона в среду сварки улучшает их соединение.
- Аргон также может быть использован в аргоновых лазерах и лазерах на красителях аргона. Лазер — это устройство, излучающее очень яркий свет одного цвета (частоты). Аргоновый лазер используется для лечения кожных заболеваний. Лазер светит сине-зеленым светом на пораженный участок кожи тела. Энергия лазера поглощается гемоглобином (кровью) и преобразуется в тепло. (Гемоглобин — это белковый пигмент красных кровяных телец в нашем организме). Кровеносные сосуды повреждаются, но затем запечатываются, что приводит к их разложению и обратному всасыванию в человеческое тело. Нежелательные наросты сглаживаются, а темные пятна становятся более светлыми, с небольшим риском образования рубцов.
- Лазер на аргоновом красителе действительно используется в глазной хирургии. Цвет света, излучаемого лазером, можно откалибровать с высокой точностью. Его можно заставить производить свет в диапазоне от зеленого до синего цветов. Каждый оттенок зеленого или синего имеет немного разную частоту. Он может проникнуть более или менее глубоко в глаз. Лазер можно модифицировать для лечения очень специфической части глаза. Краситель аргона используется для лечения опухолей, поврежденных кровеносных сосудов, состояний, включая сетчатку, и других проблем с глазами.
Соединения:
Никакого соединения благородного газа аргона никогда не производилось.
Доставка аргона и хранение
Транспортировка и хранение аргона допускается только в специализированных емкостях, газовых баллонах. В большинстве случаев для этого применяются сорокалитровые газовые баллоны. Баллоны с аргоном окрашиваются в серый цвет. Поперек баллона наносится зеленая полоса и надпись аналогичного цвета. Стандартное давление в баллонах с аргоном составляет сто пятьдесят атмосфер. В ряде случаев для снижения затрат на перевозку, аргон транспортируется в сжиженном состоянии. При этом его закачивают в специализированные ёмкости и сосуды Дюара. Также можно использовать и специализированные цистерны. Аргон не является взрывоопасным веществом. Меры предосторожности при его транспортировке в основном сводятся к тому, чтобы обеспечить сохранность самого технического газа, так как он обладает большой летучестью.
Свойства аргона (таблица): температура, плотность, давление и пр.
| Название | Аргон |
| Латинское название | Argon |
| Английское название | Argon |
| Символ | Ar |
| Атомный номер (номер в таблице) | 18 |
| Тип | Неметалл |
| Группа | Инертный (благородный) газ |
| Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Великобритания, 1894 г. |
| Год открытия | 1894 г. |
| Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| Происхождение | Природный материал |
| Содержание в атмосфере и воздухе (по массе) | 1,292 % |
| Содержание в земной коре (по массе) | 0,00015 % |
| Содержание в морях и океанах (по массе) | 0,000045 % |
| Содержание во Вселенной и космосе (по массе) | 0,02 % |
| Содержание в Солнце (по массе) | 0,007 % |
| Атомная масса (молярная масса) | 39,948(1) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| Электронная оболочка | K2 L8 M8 N0 O0 P0 Q0 R0
|
| Радиус атома (вычисленный) | 71 пм |
| Ковалентный радиус* | 106 пм |
| Радиус Ван-дер-Ваальса | 188 пм |
| Электроны, Протоны, Нейтроны | 18 электронов, 18 протонов, 22 нейтронов |
| Семейство (блок) | элемент p-семейства |
| Период в периодической таблице | 3 |
| Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| Степени окисления | 0 |
| Валентность | 0 |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 1520,57 кДж/моль (15,7596117(5) эВ) |
| Электродный потенциал | 0 |
| Энергия сродства атома к электрону | 0 кДж/моль |
| Плотность* | 0,001784 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,3954 г/см3 (при температуре кипения -185,848 °C и иных стандартных условиях, состояние вещества – жидкость),1,65 г/см3 (при -233 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| Температура плавления* | -189,34 °C (83,81 K, -308,81 °F) |
| Температура кипения* | -185,848 °C (87,302 K, -302,526 °F) |
| Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,18 кДж/моль |
| Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,53 кДж/моль |
| Молярная теплоёмкость* | 20,85 Дж/(K·моль) |
| Молярный объём | 24,2 см³/моль |
| Теплопроводность | 17,72·10-3 Вт/(м·К) (при стандартных условиях), 0,0164 Вт/(м·К) (при 300 K) |
| Структура решётки | Кубическая гранецентрированная
|
| Параметры решётки | 5,260 Å |
| Температура Дебая | 85 К |
| Название пространственной группы симметрии | Fm_ 3m |
| Номер пространственной группы симметрии | 225 |
| Номер CAS | 7440-37-1 |
Примечание:
206* Ковалентный радиус аргона согласно [1] составляет 106±10 пм.
401* Плотность аргона согласно [3] и [4] [Россия] составляет 0,0017839 г/см3 (при 0 °C /20 °C и иных стандартных условиях, состояние вещества – газ).
402* Температура плавления аргона согласно [3] и [4] составляет -189,35 °C (83,8 K, -308,83 °F) и -189,6 °C (83,55 K, -309,28 °F) соответственно.
403* Температура кипения аргона согласно [3] и [4] составляет -185,85 °C (87,3 K, -302,53 °F) и -185,9 °C (87,25 K, -302,62 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) аргона согласно [3] и [4] составляет 7,05 кДж/моль и 1,19 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) аргона согласно [3] и [4] составляет 6,45 кДж/моль и 6,51 кДж/моль соответственно.
410* Молярная теплоемкость аргона [3] составляет 20,79 Дж/(K·моль).